為進(jìn)一步鼓勵創(chuàng)新,盡快滿足晚期腫瘤患者急迫的臨床用藥需求,CDE組織召開了抗PD-1/PD-L1單抗申報資料要求專題研討會。會上,與會企業(yè)、專家和CDE審評團(tuán)隊(duì)經(jīng)過討論達(dá)成共識,并在會后進(jìn)一步征求意見,最終形成了抗PD-1/PD-L1單抗品種申報上市的資料數(shù)據(jù)基本要求,供此類藥品的研發(fā)和申報資料準(zhǔn)備參考。
在惡性腫瘤治療中,針對免疫檢查點(diǎn)的新型抗腫瘤藥物已成為生物醫(yī)藥研發(fā)熱點(diǎn)。眾所周知,目前全球范圍內(nèi)已有5個抗PD-1或PD-L1單抗藥物上市,其中以PD-1為靶點(diǎn)的單克隆抗體藥物包括:Keytruda(Pembrolizumab)、 Opdivo(Nivolumab),以PD-L1為靶點(diǎn)的單克隆抗體藥物包括:Tecentriq(Atezolizumab)、Bavenci(Avelumab)和Imfinzi(Durvalumab)。國內(nèi)已有16個同類產(chǎn)品獲得臨床批件,并在不同瘤種中開展臨床試驗(yàn)。但是截至目前,我國尚未有抗PD-1或PD-L1單抗藥物獲批上市。
為盡快滿足晚期腫瘤患者急迫的臨床需求,自2016年起,藥審中心(CDE)就該類產(chǎn)品的關(guān)鍵臨床試驗(yàn)方案設(shè)計與多家申請人進(jìn)行了多次的溝通交流。目前已有申請人開展的關(guān)鍵臨床試驗(yàn)獲得初步結(jié)果并提出上市申請(NDA)。從CDE和多家申請人的申報前溝通交流情況看,各家申請人的數(shù)據(jù)完整性及可評價性參差不齊,非常有必要對NDA申報數(shù)據(jù)質(zhì)量提出規(guī)范性要求。為此,我中心于2018年1月12日在北京召開了相關(guān)產(chǎn)品申報資料要求的專題研討會,以下就會議討論形成的、針對以客觀緩解率(ORR)為主要終點(diǎn)的單臂臨床研究結(jié)果申報上市的臨床資料的基本要求進(jìn)行具體說明。
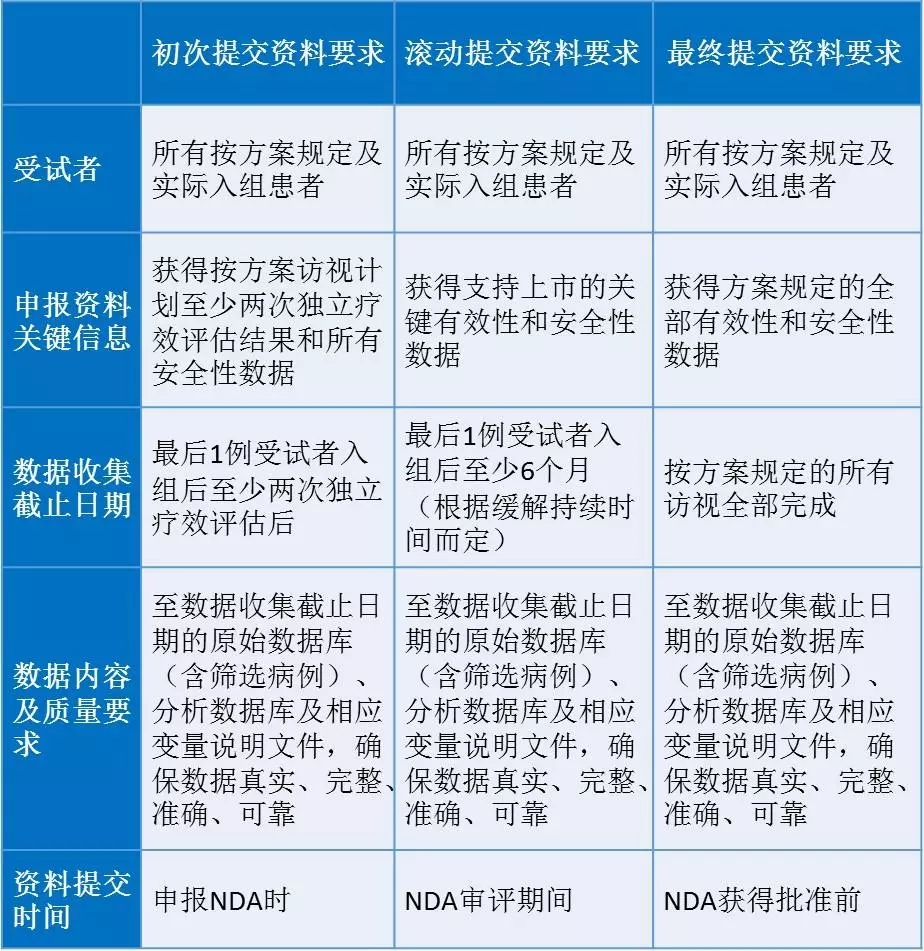
目前對于通過溝通交流會議討論的、在復(fù)發(fā)難治且無標(biāo)準(zhǔn)治療的晚期惡性腫瘤患者中,開展以O(shè)RR為主要終點(diǎn)的單臂研究進(jìn)行有條件批準(zhǔn)的品種,需要獲得支持上市的關(guān)鍵有效性和安全性數(shù)據(jù)。申報資料可以分次進(jìn)行滾動提交(具體要求見附表):
(一)初次提交時需提交所有方案規(guī)定及實(shí)際入組患者的至少兩次獨(dú)立療效評估的有效性數(shù)據(jù)和所有安全性數(shù)據(jù)。
(二)在NDA審評期間,可以滾動提交根據(jù)緩解時間獲得最后1例受試者入組后至少6個月的有效性和安全性數(shù)據(jù)。
(三)在NDA獲得批準(zhǔn)前應(yīng)提交按方案規(guī)定的全部有效性和安全性數(shù)據(jù)。
同時要求申請人在提交NDA申請之前提出pre-NDA會議申請,CDE會根據(jù)品種的具體情況,決定是否需要召開pre-NDA會議以及召開會議的形式,不同的專業(yè)也可以視情況分別召開會議。在pre-NDA會議上CDE與企業(yè)充分溝通并形成會議紀(jì)要,之后符合上述申報生產(chǎn)臨床資料要求的品種后續(xù)按程序提交NDA申請,并可同時申請優(yōu)先審評的資格。一旦獲得優(yōu)先審評資格,將在技術(shù)審評、藥品檢驗(yàn)、生產(chǎn)現(xiàn)場核查、臨床核查等各個環(huán)節(jié)予以優(yōu)先。
附表:申報資料提交的具體要求