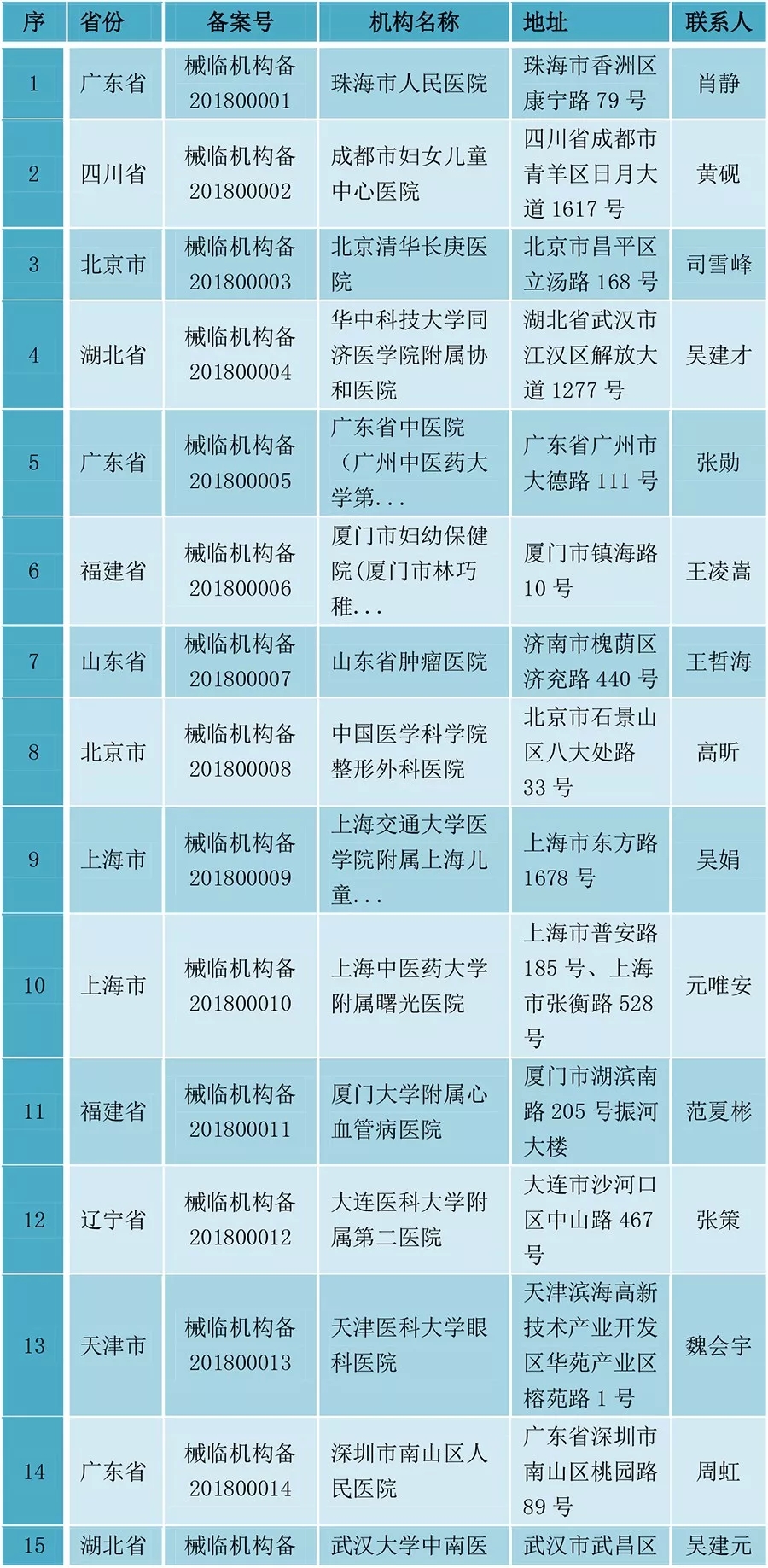
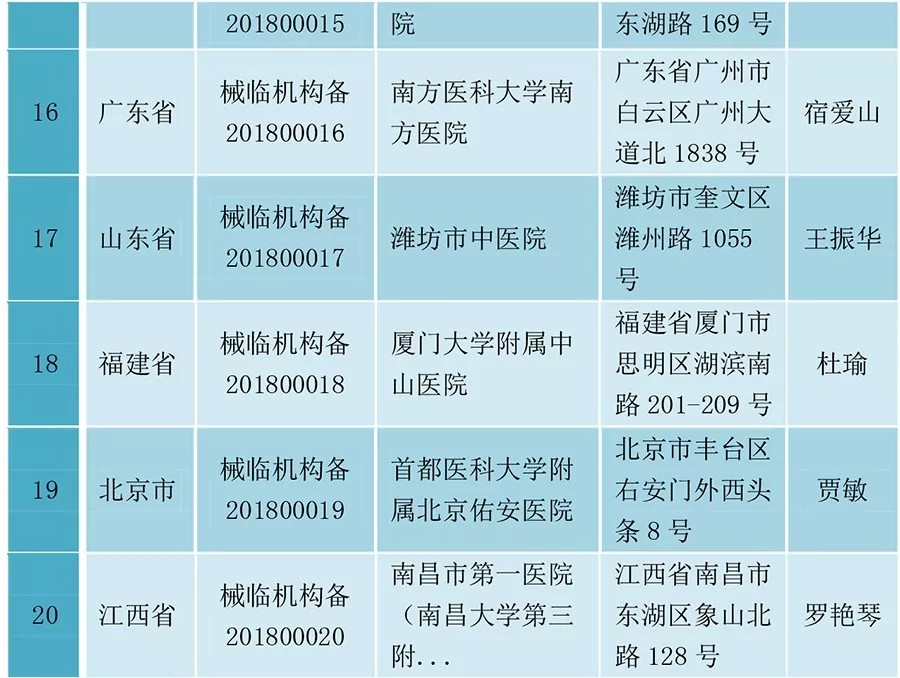
醫(yī)械臨床試驗(yàn),獲CFDA備案的20家醫(yī)院名單
去年8月4日,CFDA發(fā)布了“關(guān)于征求《醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)條件和備案管理辦法(征求意見(jiàn)稿)》意見(jiàn)的函”,醞釀多時(shí)的醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)大放開(kāi)獲重大突破。
該辦法要求,在國(guó)內(nèi)開(kāi)展醫(yī)療器械臨床試驗(yàn),應(yīng)當(dāng)在通過(guò)資質(zhì)認(rèn)定的醫(yī)療機(jī)構(gòu)專業(yè)范圍內(nèi)進(jìn)行,對(duì)列入需進(jìn)行臨床試驗(yàn)審批目錄的第三類醫(yī)療器械,應(yīng)當(dāng)在通過(guò)資質(zhì)認(rèn)定的三級(jí)甲等醫(yī)療機(jī)構(gòu)專業(yè)范圍內(nèi)開(kāi)展。
隨后,CFDA建設(shè)了相關(guān)的備案管理信息平臺(tái),據(jù)該平臺(tái),截止2018年2月11日,已有20家醫(yī)院成功備案,可以開(kāi)展列入審批目標(biāo)的第三類醫(yī)療器械的臨床試驗(yàn)活動(dòng)。